Глутаматдекарбоксилаза
| Глутаматдекарбоксилаза 1 | |
|---|---|
| Обозначения | |
| Символы | GAD1; FLJ45882, GAD, GAD67, SCP |
| Entrez Gene | 2571 |
| HGNC | 4092 |
| OMIM | 605363 |
| UniProt | Q99259 |
| Другие данные | |
| Шифр КФ | 4.1.1.15 |
| Локус | 2-я хр., 2q31 |
| Глутаматдекарбоксилаза 2 | |
|---|---|
| Обозначения | |
| Символы | GAD2; GAD65, MGC161605, MGC161607 |
| Entrez Gene | 2572 |
| HGNC | 4093 |
| OMIM | 138275 |
| PDB | 1ES0 |
| UniProt | Q05329 |
| Другие данные | |
| Шифр КФ | 4.1.1.15 |
| Локус | 10-я хр., 10p11.23 |


Глутаматдекарбоксилаза (англ. Glutamate decarboxylase, GAD, GAD65, GAD67, шифр КФ 4.1.1.15) — фермент, катализирующий преобразование глутамата в ГАМК посредством декарбоксилирования по следующей реакции:
- HOOC-CH2-CH2-CH(NH2)-COOH → CO2 + HOOC-CH2-CH2-CH2NH2.
Кофактором GAD является пиридоксальфосфат.
В организме млекопитающих GAD существует в виде двух изоформ — GAD67 и GAD65, кодируемых двумя генами — GAD1 и GAD2 (локализованы на 2-ой (GAD1) и 10-ой хромосомах (GAD2) соответственно). Коды 67 и 65 указывают на молекулярный вес изоформ — 67 кДа и 65 кДа. Оба гена экспрессированы в мозге, использующем ГАМК в качестве нейротрансмиттера, GAD2 также экпрессирован в поджелудочной железе. GAD65 обнаруживается в основном в синаптических терминалях, а GAD67 также и в теле нейрона и в аксонах.[3]
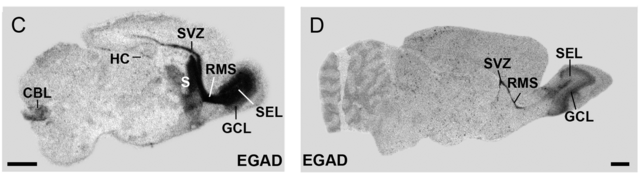
Известны как минимум два дополнительных транскрипта GAD1, I-80 и I-86, они обнаружены в мозге на стадии эмбрионального развития (англ. EGAD; embryonic GAD). Оба транскрипта кодируют ферментативно неактивную разновидность белка массой 25 kDa (GAD25), а I-80 - также ферментативно активный белок GAD44.[4] По данным одного исследования на крысах, эмбриональные формы GAD67 и после рождения обнаруживаются в областях активного нейрогенеза, нейромиграции и интеграции новых нейронов: субвентрикулярной зоне, ростральном миграционном тракте и обонятельной луковице.[1]
Исследования на животных
У мышей, нокаутных по GAD65, не отмечено изменения концентрации ГАМК в мозге и отклонений в поведении, за исключением несколько повышенной склонности к судорогам. Напротив, GAD-67 нокаут вызывает нарушение развития и гибель грызунов вскоре после рождения. У GAD67-нокаутных мышей отмечается расщепление нёба, но в структуре мозга не заметно явных дефектов.[5][6]
При индукции судорог у грызунов наблюдается всплеск экспрессии GAD67 в зубчатой извилине гиппокампа.[7]
Роль в патологии
Появление аутоантител к GAD65 и GAD67 иногда предшествует развитию инсулинзависимого сахарного диабета.[8] FT, FT. Отмечается схожесть GAD65 с аминокислотными последовательностями некоторых вирусов (например, P2-C белком coxsackievirus), и это гипотетически может играть роль в развитии аутоиммунной реакции, однако твёрдых подтверждений существования такого механизма развития диабета у человека пока не получено.[9] Проводятся исследования рекомбинантного GAD65 (Diamyd) для замедления либо предотвращения развития аутоиммунного диабета.
Значительное снижение экспрессии GAD67 отмечается в ГАМК-эргических интернейронах мозга при шизофрении и психотической форме биполярного расстройства.[10][11] Одна из рабочих гипотез ("эпигенетическая") связывает это с повышенным уровнем ДНК метилтрансферазы-1. [12] Уровень DMNT1 варьирует в разных слоях ГАМК-эргических нейронов и наряду с GAD67 предположительно может снижать экспрессию белка рилин.[13] При этом стоит отметить, что данные результаты получены при анализе образцов мозга пациентов, длительное время получавших антипсихотическую терапию, способную вносить изменения в работу мозга и экспрессию GAD,[14] а также на животных моделях.
Также антитела к GAD часто обнаруживаются у пациентов с редким синдромом мышечной скованности.[15]
В одной семье, члены которой страдают редкой спастической квадриплегией (OMIM 603513), отмечена миссенсная мутация гена GAD1.[16]
На основании данных о вызванном GAD67-нокаутом расщеплении нёба у мышей,[5][6] Kanno et al. провели генетический анализ вариаций гена GAD1 в японской популяции, и результаты показали, что гаплотипы гена могут играть роль в расщеплении губы и нёба у людей.[17]
Литература
- Б.С.Сухарева, Е.Л.Дарий, Р.Р.Христофоров Глутаматдекарбоксилаза: структура и каталитические свойства - "Успехи биологической химии", 2001
Ссылки
- * Genetics, Expression Profiling Support GABA Deficits in Schizophrenia - Форум исследования шизофрении. Обзор трех публикаций, связанных с GAD. Перевод: Свидетельства ГАМК-дефицита при шизофрении (недоступная ссылка)
- Epigenetic Jamming of GAD1 Promoter May Contribute to Schizophrenia - Schizophrenia Research Forum, обзор публикации. Перевод: Эпигенетическое подавление экспрессии GAD1 при шизофрении (недоступная ссылка)
Примечания
- ↑ 1,0 1,1 1,2 Popp A., Urbach A., Witte O.W., Frahm C. Adult and embryonic GAD transcripts are spatiotemporally regulated during postnatal development in the rat brain (англ.) // PLoS ONE : journal. — 2009. — Vol. 4, no. 2. — P. e4371. — doi:10.1371/journal.pone.0004371. — PMID 19190758.
- ↑ Dynamic expression of a glutamate decarboxylase gene in multiple non-neural tissues during mouse development. Maddox DM, Condie BG. BMC Dev Biol. 2001;1:1. Epub 2001 Jan 8. PMID 11178105
- ↑ Kaufman DL, Houser CR, Tobin AJ. Two forms of the gamma-aminobutyric acid synthetic enzyme glutamate decarboxylase have distinct intraneuronal distributions and cofactor interactions. J Neurochem. 1991;56:720–723. PMID 1988566
- ↑ Szabo G, Katarova Z, Greenspan R. Distinct protein forms are produced from alternatively spliced bicistronic glutamic acid decarboxylase mRNAs during development. Mol Cell Biol. 1994;14:7535–7545. PMID 7935469
- ↑ 5,0 5,1 Asada, H.; Kawamura, Y.; Maruyama, K.; Kume, H.; Ding, R.-G.; Kanbara, N.; Kuzume, H.; Sanbo, M.; Yagi, T.; Obata, K. : Cleft palate and decreased brain gamma-aminobutyric acid in mice lacking the 67-kDa isoform of glutamic acid decarboxylase. Proc. Nat. Acad. Sci. 94: 6496-6499, 1997. PMID 9177246
- ↑ 6,0 6,1 Condie, B. G.; Bain, G.; Gottlieb, D. I.; Capecchi, M. R. : Cleft palate in mice with a targeted mutation in the gamma-aminobutyric acid-producing enzyme glutamic acid decarboxylase 67. Proc. Nat. Acad. Sci. 94: 11451-11455, 1997. PMID 9326630
- ↑ Szabo G, Kartarova Z, Hoertnagl B, Somogyi R, Sperk G. Differential regulation of adult and embryonic glutamate decarboxylases in rat dentate granule cells after kainate-induced limbic seizures. Neuroscience. 2000;100:287-295. PMID 11008167
- ↑ Baekkeskov S, Aanstoot HJ, Christgau S, Reetz A, Solimena M, Cascalho M, Folli F, Richter-Olesen H, De Camilli P. (1990) Identification of the 64K autoantigen in insulin-dependent diabetes as the GABA-synthesizing enzyme glutamic acid decarboxylase. Nature. 347(6289):151-6. PMID 1697648
- ↑ Albert L.J., Inman R.D. Molecular mimicry and autoimmunity (англ.) // The New England Journal of Medicine : journal. — 1999. — December (vol. 341, no. 27). — P. 2068—2074. — PMID 10615080.
- ↑ Woo TU, Walsh JP, Benes FM. (2004) Arch Gen Psychiatry. 61(7):649-57. Density of glutamic acid decarboxylase 67 messenger RNA-containing neurons that express the N-methyl-D-aspartate receptor subunit NR2A in the anterior cingulate cortex in schizophrenia and.PMID 15237077
- ↑ Guidotti, A., Auta, J., Davis, J. M., DiGiorgi-Gerenini, V., Dwivedi, J., Grayson, D. R., Impagnatiello, F., Pandey, G. N., Pesold, C., Sharma, R. F., et al. (2000) Decrease in reelin and glutamic acid decarboxylase67 (GAD67) expression in schizophrenia and bipolar disorder: a postmortem brain study.Arch. Gen. Psychiatry 57, 1061—1069. PMID 11074872
- ↑ Ruzicka WB, Zhubi A, Veldic M, Grayson DR, Costa E, Guidotti A. (2007) Selective epigenetic alteration of layer I GABAergic neurons isolated from prefrontal cortex of schizophrenia patients using laser-assisted microdissection. Mol Psychiatry. PMID 17264840 doi:10.1038/sj.mp.4001954.
- ↑ Kundakovic M, Chen Y, Costa E, Grayson DR. (2006) DNA Methyltransferase Inhibitors Coordinately Induce expression of the Human Reelin and GAD67 Genes. Mol Pharmacol. PMID 17065238 [http://web.archive.org/web/20070926235405/http://molpharm.aspetjournals.org/cgi/reprint/mol.106.030635v1 Архивная копия от 26 сентября 2007 на Wayback Machine Архивная копия от 26 сентября 2007 на Wayback Machine полный текст в свободном доступе (формат PDF) (англ.)]
- ↑ Fatemi S.H., Reutiman T.J., Folsom T.D. Chronic psychotropic drug treatment causes differential expression of Reelin signaling system in frontal cortex of rats (англ.) // Schizophr. Res. : journal. — Elsevier, 2009. — April. — doi:10.1016/j.schres.2009.03.002. — PMID 19359144.
- ↑ Lohmann T., Hawa M., Leslie R.D., Lane R., Picard J., Londei M. Immune reactivity to glutamic acid decarboxylase 65 in stiffman syndrome and type 1 diabetes mellitus (англ.) // The Lancet : journal. — Elsevier, 2000. — July (vol. 356, no. 9223). — P. 31—5. — doi:10.1016/S0140-6736(00)02431-4. — PMID 10892762.
- ↑ Lynex C.N., Carr I.M., Leek J.P., Achuthan R., Mitchell S., Maher E.R., Woods C.G., Bonthon D.T., Markham A.F. Homozygosity for a missense mutation in the 67 kDa isoform of glutamate decarboxylase in a family with autosomal recessive spastic cerebral palsy: parallels with Stiff-Person Syndrome and other movement disorders (англ.) // BMC Neurol : journal. — 2004. — November (vol. 4, no. 1). — P. 20. — doi:10.1186/1471-2377-4-20. — PMID 15571623.
- ↑ Kanno, K.; Suzuki, Y.; Yamada, A.; Aoki, Y.; Kure, S.; Matsubara, Y. : Association between nonsyndromic cleft lip with or without cleft palate and the glutamic acid decarboxylase 67 gene in the Japanese population. Am. J. Med. Genet. 127A: 11-16, 2004. PMID 15103710